-
Elektrolyse is het proces waarbij elektriciteit reageert met water waardoor waterstof en zuurstof gescheiden worden en je zuiver waterstofgas produceert
-
Een moderne elektrolyse-installatie heeft een rendement van ca 80%, het bedrijf Hyasa heeft recentelijk een een rendement van 95% bereikt
-
Door het steeds geoptimaliseerde elektrolyse-proces kan de prijs van 1 kilogram waterstof naar 1,50 US$ gaan
Elektrolyse is de vorm van waterstof productie waarbij groene elektriciteit, van bijvoorbeeld wind- of zonneparken, reageert met gedestilleerd water. Hierbij komt waterstof en zuurstof vrij waarbij het waterstof gebruikt kan worden als energiebron. In dit artikel gaan we onderzoeken wat elektrolyse is, welke vormen er zijn en behandelen we verschillende factoren zoals rendement en de kosten van een installatie.
Wat is elektrolyse met betrekking tot waterstof?
In de zoektocht naar milieuvriendelijke brandstoffen, zijn vele ogen gericht op waterstof. Waterstofgas kan gebruikt worden als brandstof voor auto’s en hierdoor CO2 uitstoot verminderen. Echter wordt het leeuwendeel van het waterstofgas geproduceerd aan de hand van fossiele brandstoffen. Wat wél een groene vorm van waterstof productie is, is het opwekken van waterstofgas aan de hand van elektrolyse.
Waterstof is bijna nergens zomaar in zijn puurste vorm te vinden (witte waterstof). We moeten hierdoor zelf waterstof produceren waarbij we water zoals we dit kennen, scheiden in waterstof en zuurstof. Er is sprake van elektrolyse wanneer je waterstof en zuurstof splits aan de hand van elektriciteit. Wanneer deze elektriciteit is opgewekt uit duurzame energiebronnen zoals wind- of zonne-energie, is er sprake van groene waterstof. Deze vorm van waterstofproductie is niet zomaar komen aanwaaien. Al in 1807 werd deze vorm van waterstofproductie ontdekt door Humphry Davy.
Bij elektrolyse wordt elektriciteit door heel zuiver gedestilleerd water heengestuurd waarbij water (H2O) wordt gescheiden in waterstof (H2) en zuurstof (O). De scheikundige formule ziet er dan als volgt uit:

Hoe werkt elektrolyse van water?
Laten we iets meer de diepte in gaan omtrent elektrolyse van water. Aan de hand van elektriciteit wordt waterstof gescheiden van waterstof, maar hoe verloopt dit proces precies? Elektrolyse van water gebeurd in een elektrolysesysteem, wanneer je meerdere van deze systemen hebt spreken we van een elektrolyse-installatie.
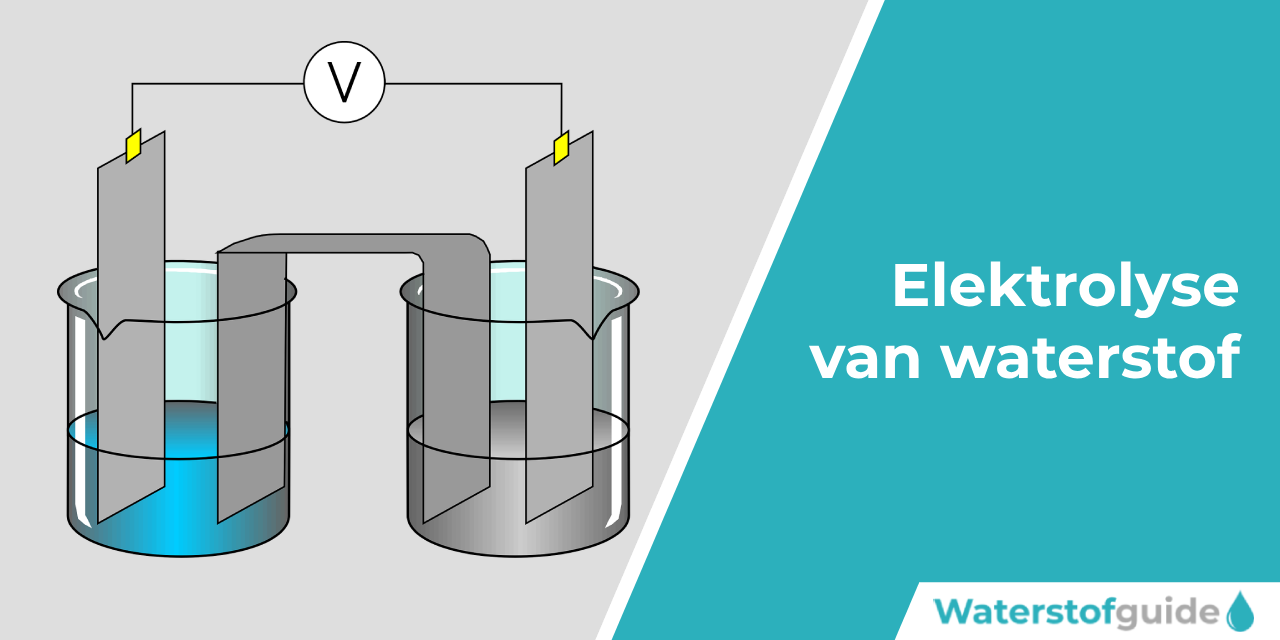
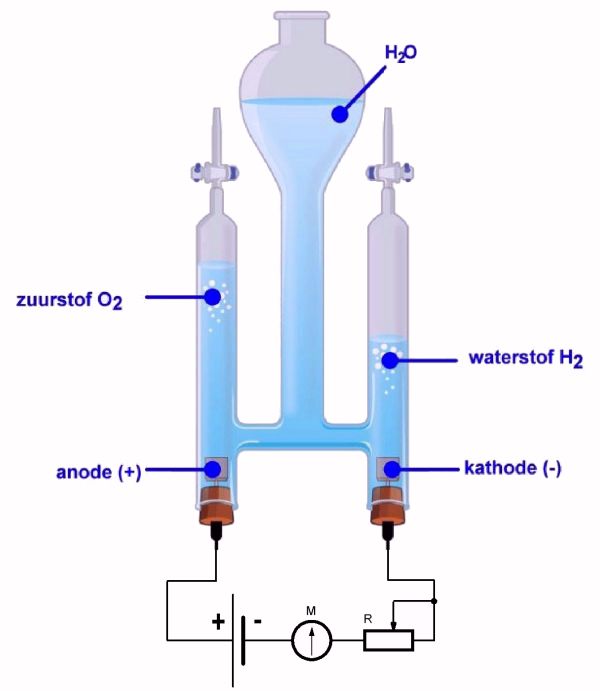
Een elektrolysesysteem bestaat uit verschillende onderdelen die allemaal in verbintenis met elkaar staan. In essentie is het een vat met water waarin één elektrolyt en twee elektroden met een kathode en anode zich bevinden. De kathode is hierbij de negatieve pool en de anode de positieve pool. Wanneer er elektriciteit naar beide elektroden worden geleiden, zullen aan de twee kanten van het elektrolyt een reactie plaatsvinden. In de afbeelding hiernaast / hieronder kan je zien hoe een elektrolysesysteem er ongeveer uit ziet.
Zo komt aan de kathode waterstofgas vrij en bij de anode is dit zuurstof. Het ratio waterstof / zuurstof bestaat hierbij uit 1:9. Het zuurstof wordt losgelaten of opgevangen en het waterstofgas wordt omgezet in een vloeibare vorm. Dit proces van het omzetten van waterstofgas naar vloeibaar waterstof gebeurd aan de hand van een liquidalizer.
Vormen van elektrolyzers
Het werkende principe van een elektrolyzer hebben we nu al uitgelegd, maar er zijn ook verschillende vormen van elektrolyzers, namelijk de alkaline en PEM elektrolyzers. Beiden hebben net iets andere specificaties en hebben dan ook zo hun eigen voor- en nadelen.
De alkaline electrolyzer gebruikt een vloeibaar alkalisch elektrolyt om water te splitsen in waterstof en hydroxide-ionen bij de kathode. Deze ionen reageren bij de anode tot water en zuurstof. De totale reactie is: H2O → H2 + ½ O2. Voor deze reactie is ongeveer 285 kJ/mol duurzame energie nodig, bestaande uit warmte en elektriciteit. De elektrolyse vindt plaats bij temperaturen tussen 40 en 90 ℃.
Hoewel electrolyzers met een vloeibaar alkalische oplossing van natrium- of kaliumhydroxide als elektrolyt al lange tijd beschikbaar zijn en succesvol zijn in de productie van waterstof, hebben ze enkele nadelen, zoals een lage stroomdichtheid van de cellen en de beperking dat ze niet onder hoge druk kunnen werken, waardoor ze relatief groot in omvang zijn.
Een PEM electrolyser gebruikt een polymeer membraan dat alleen waterstofionen doorlaat. Het membraan zorgt ervoor dat water bij de anode wordt gesplitst in zuurstof, waterstofionen en elektronen, waarna de waterstofionen en elektronen de kathode bereiken en worden omgezet in waterstof.
Zowel bij de anode als de kathode vinden chemische reacties plaats:
- Anode: H2O → H2 + ½ O2 + 2e
- Kathode: 2H+ + 2e → H2
De PEM electrolyser heeft als voordeel ten opzichte van de alkaline electrolyser dat hij onder druk kan werken en daardoor compacter kan zijn. Er zijn echter ook nadelen, zoals de noodzaak om onder zeer zure omstandigheden te werken, wat speciale eisen aan het systeem stelt.
Rendement van waterstof elektrolyse
Het rendement dat een elektrolyzer heeft is van groot belang met betrekking tot het kostenplaatje. Waterstofgas is een energiebron, maar er moet ook energie ingestoken worden om het te produceren. Een kg waterstof bevat 39,4 kWh aan energie, in een standaard elektrolysesysteem kost het 52,5 kWh aan energie om dit kilo te produceren. Dit betekent dat er een gemiddeld rendement van (39,4 / 52,5 x 100) 75% is. Ongeveer een kwart van de energie gaat hierbij verloren.
Het bedrijf Hysata heeft een elektrolyse-systeem ontwikkeld wat dit proces veel efficiënter kan uitvoeren. Zo heeft het Australische bedrijf de benodigde energie voor een kilo waterstof teruggedrongen naar 41,5 kWh. Dit betekent een rendement van 94,9%, wat tevens een efficiëntierecord betekent. De reden voor deze verbeterde efficiëntie is het gebruik van het nieuwe soort elektrode materiaal, maar hier wilt Hysata niet te veel over prijsgeven. Wel betekent dit dat de kosten voor het produceren van een kg waterstof flink omlaag zouden kunnen gaan. Hysata verwacht in de nabije toekomst dat ze één kilogram waterstof kunnen produceren voor om en nabij de 1,50 US$.
Wanneer de efficiëntie van elektrolyse geoptimaliseerd blijft worden, zullen de kosten flink teruglopen. De hoge kosten van elektrolyse aan de hand van groene wind-/ en zonne-energie is nu nog een reden waardoor de vraag naar waterstof relatief laag is.